科学研究发现补充NMN可以增强和改善与年龄相关的认知功能障碍
2018年11月8日国际期刊Nature Partner Journals发表了来自华盛顿大学医学院肖恩约翰逊博士和大卫F.沃兹尼亚克博士的抗衰老研究报告《CA1 Nampt knockdown recapitulates hippocampal cognitive phenotypes in old mice which nicotinamide mononucleotide improves》表明短期补充NMN可以增强老年小鼠海马中的Cask表达。NAD +CA1区域的减少有助于改善与年龄相关的认知功能障碍。

前言
认知功能障碍是全球人口老龄化中最令人关注的结果之一。然而,衰老程中认知功能受损的机制仍然难以捉摸。已确定NAD +水平在多个组织和器官中减少,包括脑。我们发现NAD +在衰老过程中小鼠海马体积水平下降,而我们观察到老年小鼠空间学习/记忆能力的年龄相关影响最小,我们发现它们在情境恐惧条件反射试验中对厌恶刺激产生了认知超敏反应。这种认知超敏反应似乎与情绪(恐惧/焦虑)和感觉处理(休克敏感性)的改变有关,而不是在衰老过程中反映真正的调理/保留效应。补充烟酰胺单核苷酸(NMN)改善了超敏反应的感觉加工方面以及可能的其他相关行为。烟酰胺磷酸核糖转移酶的特异性敲低(Nampt)在CA1区域,但不在齿状回中,概括了在老鼠中观察到的这种认知超敏反应。我们鉴定了钙/钙调蛋白依赖性丝氨酸蛋白激酶(Cask)作为潜在的下游效应物,以响应海马中与年龄相关的NAD +减少。Cask表达对NAD +变化有反应,并且在衰老期间也在海马体中减少。短期NMN补充可以增强老鼠小鼠海马中的Cask表达。其启动子活性以Sirt1依赖性方式调节。合起来,NAD +CA1区域的减少有助于发展与年龄相关的认知功能障碍,其方面可以通过补充NAD +中间体(例如NMN)来增强NAD +可用性来预防或治疗。
简介
人口老龄化是全世界许多国家非常关注的话题。仅在美国,预计到2050年,65岁或65岁以上的人口将达到近8300万,占人口的20%以上。1衰老是多种生理功能衰退,导致各种组织和器官的强健性丧失,最终导致各种侮辱的易感性增加,并且易患多种疾病。中枢神经系统不能免受衰老的影响。在美国,超过71岁的人中有22%发生认知障碍。2同样普遍的是精神障碍,例如焦虑症,其占老年人的10-20%,并且使其比痴呆症或重度抑郁症更常见。3那些患有焦虑症中,90%被认为是广泛性焦虑症(GAD)或特定恐惧症,GAD和占这些病例的50%。4,5晚年焦虑障碍将不仅对个人,而且医疗系统作为一个整体显著的经济负担。随着人口老龄化的加剧,解决这些问题并提供有意义的福利和改善生活质量的决议已成为一个日益重要的问题。
已经成为一种共识,维持烟酰胺腺嘌呤二核苷酸(NAD +),一种用于氧化还原反应的经典辅酶和用于NAD +消耗酶的底物,对于多种组织和器官的强大功能是至关重要的。6,7,8在老化的过程中,然而,NAD水平+在多个外周组织和在脑中,特别是在海马,显著下降。6老化过程中NAD +水平的这种全身性降低部分是由于烟酰胺磷酸核糖基转移酶(NAMPT)的减少,NAMPT是主要NAD +中的限速酶哺乳动物的生物合成途径。6,7,8有用于合成NAD五个主要前体+:色氨酸,烟酰胺和烟酸(两种形式的维生素B 3),烟酰胺核糖核苷,和烟酰胺单核苷酸。其中,烟酰胺是哺乳动物NAD +生物合成的主要前体,并被NAMPT 转化为烟酰胺单核苷酸(NMN),一种关键的NAD +中间体。烟酰胺/烟酸单核苷酸腺苷酰转移酶(NMNAT)将NMN转化为NAD +。6,7,8事实上,已经证明,长达12个月的NMN补充剂可有效缓解常规饲喂正常B6小鼠的多种年龄相关功能衰退,9暗示可能使用NMN作为预防和治疗抗衰老介入。
许多酶,包括聚-ADP-核糖聚合酶,sirtuins和CD38 / CD157胞外酶,依赖于在整个身体中连续供应NAD +。Sirtuins是一类NAD +依赖性脱乙酰酶/脱酰酶,其在将营养信号整合到各种生理反应中具有重要作用。Sirtuins调节许多关键的生物过程,包括代谢,应激反应,DNA修复,染色质重塑,昼夜节律和衰老。10,11有七个哺乳动物乙酰化酶,SIRT1-7,其中几位已经报道,在哺乳动物的大脑中发挥重要作用。例如,已证明SIRT1可调节长期增强和学习记忆。12,13 SIRT1还促进阿尔茨海默病和亨廷顿病小鼠模型的认知功能。14,15,16,我们也证明了这两种SIRT1和SIRT2是很重要的促进神经干/祖细胞分化的少突胶质细胞。17有趣的是,SIRT1和SIRT2也被连接到抑郁行为。18,19
我们之前的研究表明,前脑兴奋性神经元中的NAMPT对认知和行为功能至关重要。17,20在这些研究中,我们使用缺乏小鼠NAMPT(前脑兴奋性神经元CaMKIIαNampt - / -小鼠)。尽管这些小鼠表现出显着的表型,证明了NAMPT在海马认知功能中的重要性,但很难知道NAMPT介导的NAD +生物合成是否确实有助于海马认知功能的年龄相关变化。因此,我们决定评估年轻和老年小鼠之间认知和行为功能的差异。然后,我们检查了是否有任何海马区域特异性的Nampt敲低可以概括在老年小鼠中观察到的认知表型。我们在这项研究中的发现揭示了NAMPT介导的NAD +生物合成在海马认知功能的年龄相关性下降中的重要性。
结果
NMN补充剂改善老年小鼠的认知超敏反应
已经确定NAD +水平在衰老过程中在多个组织和器官中下降。6在海马中,我们能够确认类似的NAD +下降(图1a)。比较2,7和19个月龄的海马NAD +水平,我们观察到NAD +逐渐减少~40%(图1a)。检查是否有任何认知和行为障碍与此NAD +相关减少,我们为2个月和20个月大的老鼠进行了一系列认知和行为分析。此外,我们决定评估另一组20个月大的小鼠,其中通过口服强饲法给予NMN(300mg / kg /天)约3周。在包括我们在内的许多研究中已经证明,NMN补充剂可以避免由老年小鼠中NAMPT表达降低引起的NAD +减少。6事实上,我们证实NMN政府能够增加海马NAD +水平显著老龄小鼠(补充图1)。
首先在1小时的运动活动测试中评估磷酸盐缓冲盐水(PBS)处理的年轻,PBS处理的老鼠和NMN处理的老鼠组,然后评估一组感觉运动测量值。对1小时运动活动测试的总体移动(全身运动)数据进行的重复测量方差分析(rmANOVA)显示无显着的组效应,尽管存在显着的时间相互作用组(图1b; F ( 10,185) = 4.31,p = 0.0001)。相互作用效应的一个重要组成部分是由于PBS处理的年轻组和PBS处理的老组在前10分钟时间点之间的差异(p 在PBS处理的年轻组和NMN处理的旧组之间相同的时间间隔(p = 0.002)。来自感觉运动电池的数据分析表明,年轻小鼠通常表现优于旧组,特别是在平台,杆和60°倾斜筛测试中(补充图2)。
随后在Morris水迷宫(MWM)中评估小鼠的空间学习和记忆能力。来自提示试验(可见平台;可变位置)的逃逸路径长度数据产生了显着的群体效应(图1c ; F (2,37) = 3.86,p = 0.030)和一个重要的逐个群体相互作用(F(6) ,111) = 2.45,p = 0.038)。这种相互作用的主要原因是,在第一次治疗期间,与年轻组相比,PBS治疗和NMN治疗的老年组的路径长度显着增加(p = 0.017和p) 分别= 0.002)。虽然两个老组在最初暴露于MWM期间表现出性能受损,但在所提示试验结束时,所有三组均表现出相当的水平。在提示试验期间发现了关于游泳速度的组效应(图1d ; F ( 2,37 ) = 11.81,p = 0.0001)。在整个训练过程中,年轻小鼠游泳的速度明显快于PBS处理组和NMN处理组中的老鼠(分别为p <0.00005和p = 0.027),而NMN处理的老鼠游泳速度比PBS快处理过的老鼠(p = 0.012)。在PBS处理的年轻与PBS处理的老鼠之间,效果的幅度似乎最大,因为 在四个会话中的每一个都发现了显着的差异(超过Bonferroni校正:p <0.05 / 4 = 0.0125)(所有p值< 0.0025),而 在年轻和NMN治疗的老年小鼠之间仅观察到第 2阶段(p = 0.038)的大差异,而对于NMN治疗的老年人与PBS治疗的老年小鼠仅观察到区块4(p = 0.006)。
对地方试验(隐藏平台,单一位置;测试空间学习)的逃逸路径长度数据的分析表明,没有涉及群体变量的显着主要或相互作用效应,表明三组之间的可比获得水平(图1e))。会话的显着影响(F ( 4,68 ) = 21.69,p <0.00005)表明,通常,各组在各会话期间显示出显着的改善,表明已经发生了学习。在第1阶段与第5阶段之间对每个组进行的主题内比较也显示每组的性能显着改善(全部 p值<0.009)。与提示试验的结果相似,在放置条件下观察到游泳速度的显着差异(图1f ;组效应:F ( 2,17 ) = 5.11,p = 0.018),简单主效应试验结果显示PBS处理的幼鼠比PBS和NMN处理的老组游泳更快( 平均p = 0.007和p = 0.027),而两个老组显示相似的游泳速度(图1f)。显着的群体效应(F ( 2,37 ) = 4.40, p 关于探针试验期间的平台交叉(平台移除;测试保留),表明各组之间在保留性能方面存在差异,随后的成对比较显示PBS处理的幼鼠在前一平台上产生更多的交叉点位置比PBS治疗的旧组(p = 0.010)或NMN治疗的老组(p = 0.019),而较老的组表现相似(图1g)。然而,所有组都显示出目标象限的空间偏差(图 1h)。此外,与旧组相比,年轻组有更多时间在目标象限中,并且NMN治疗组与PBS治疗的老鼠相比,在目标象限中花费更多时间(图1h) 。
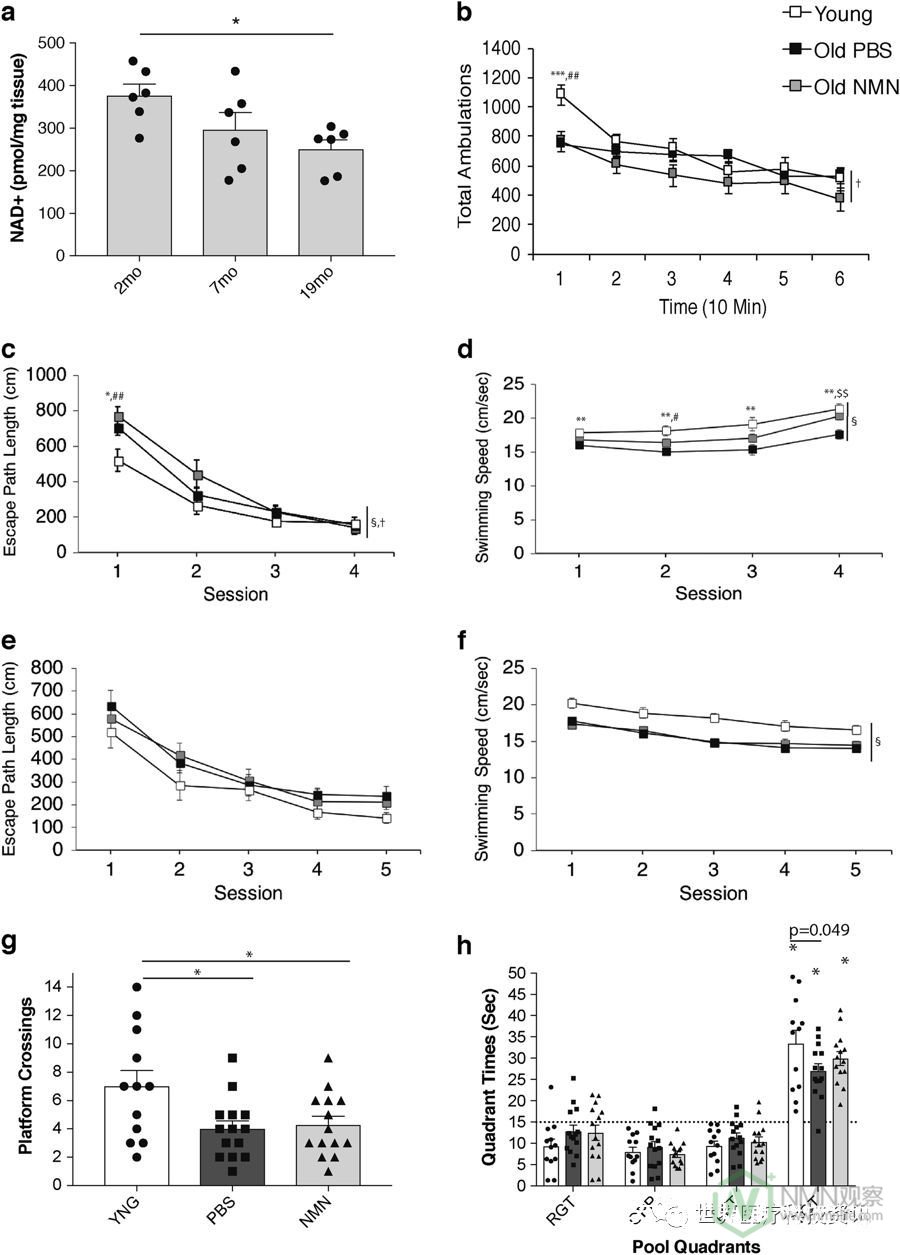
老鼠显示海马NAD +水平显着降低,但保留其空间获得和学习能力。在2,7和19个月龄的雄性小鼠中的海马NAD +水平(n = 6; * p <0.05,具有LSD事后检验的单向ANOVA)。b在PBS治疗的2个月大(n = 12),PBS治疗的20个月大(n = 14)和NMN治疗的20个月大的1小时运动活动测试中测量总行动。(n = 14)雄性小鼠。c - h评估PBS治疗的2个月大(n = 12),PBS治疗的20个月大( 在MWM测试中 ,n = 14)和NMN处理的20个月大(n = 14)雄性小鼠。显示了在提示(c,d)和位置(e,f)条件期间的逃生路径长度和游泳速度。还示出了在探测条件期间在每个象限(h)中花费的平台交叉(g)和时间。数据表示为平均值±SE。通过(b-f)的双向重复测量ANOVA 和(a,g,h)的单向ANOVA 进行统计分析。)。重要的群体效应和按时间或会话的相互作用用图表右侧的符号表示(分别为§和†)。b - f * p <0.05,**,##,$$ p <0.01,***,### p <0.001(*,**,***用于PBS处理的年轻人与PBS处理的老年人小鼠; #,##对PBS治疗的年轻与NMN处理大的老鼠; $$对于PBS处理旧与NMN处理大的老鼠)。 与PBS处理的幼小鼠比较,g * p <0.05。h表示目标象限的显着空间偏差(*)
完成MWM测试后,然后对条件恐惧程序评估小鼠以评估非空间巴甫洛夫调节能力。在第1天测量的基线冷冻水平的分析(图2a)显示出不显着的组效应,但是通过时间相互作用的显着组(F (2,37) = 3.95,p = 0.028)。所有三组在第1分钟期间显示出相当的冷冻水平,并且PBS处理和NMN处理的旧组在第2分钟期间与PBS处理的幼小鼠相比表现出更高的冷冻水平(p = 0.029和p = 0.032)。根据Bonferroni校正,这些差异并不显着( p 对于每分钟进行的比较,<0.05 / 2 = 0.025)。相反,在第1天响应于音调 - 休克训练的冷冻水平方面存在很大差异,其中观察到显着的组效应(图2a ; F ( 2,37 ) = 12.22,p = 0.0001) 。随后的简单主效应测试显示PBS培养和NMN处理的老鼠在3分钟的训练中平均显示出与PBS-年轻小鼠相比显着升高的冷冻水平( 每次比较p = 0.0001),观察到显着差异分钟3和4(所有p值<0.002)。第2天的情境恐惧数据产生了强大的群体效应(图2b; F ( 2,37 ) = 15.74,p <0.00005)。具体而言,PBS处理和NMN处理的老鼠在测试期间的平均分钟数与PBS处理的幼鼠相比具有显着增加的冷冻水平(图2b ;分别为p <0.00005和p = 0.0008;参见个别时间相关比较的p值的图例)。此外,与PBS处理的老鼠相比, 发现NMN处理的老鼠显示降低的冷冻水平的强烈趋势(p = 0.052),这一趋势的主要组成部分是由于在观察期间观察到的组之间的巨大差异。第 3分钟(第 3 页) = 0.001)。在第3天, 当将小鼠放入时,观察到显着的组效应(F ( 2,37 ) = 8.96,p = 0.0007)和逐组时间相互作用(F ( 2,37 ) = 7.70,p = 0.002)。一个不同的房间,包含新的环境线索(改变的背景基线)(图2c)。随后的对比显示,与年轻小鼠相比,经过PBS处理的老年小鼠表现出明显更高的冷冻水平(分别为p = 0.005和p = 0.0001),超过Bonferroni校正(p = 0.05/2 = 0.025)。此外,与年轻组相比,NMN治疗的老鼠在第 2分钟时显示出显着升高的冷冻水平(p = 0.001 ),在第 1分钟显示相当大的差异(p = 0.045),而在两分之一之间没有观察到差异。组。在第3天的听觉线索测试中也观察到显着的组效应(图2c ; F( 2,37 ) = 4.68,p = 0.015),在每个PBS处理的和NMN之间再次观察到更高的冷冻水平。治疗的老年组与年轻组相比(p = 0.007和0.019),并且这些效应的大部分是由于在6-10分钟内年轻组和老组之间的差异(见图2)。2c表示个别比较的p值)。在听觉线索测试期间,两个旧组之间的冷冻水平没有显着差异。
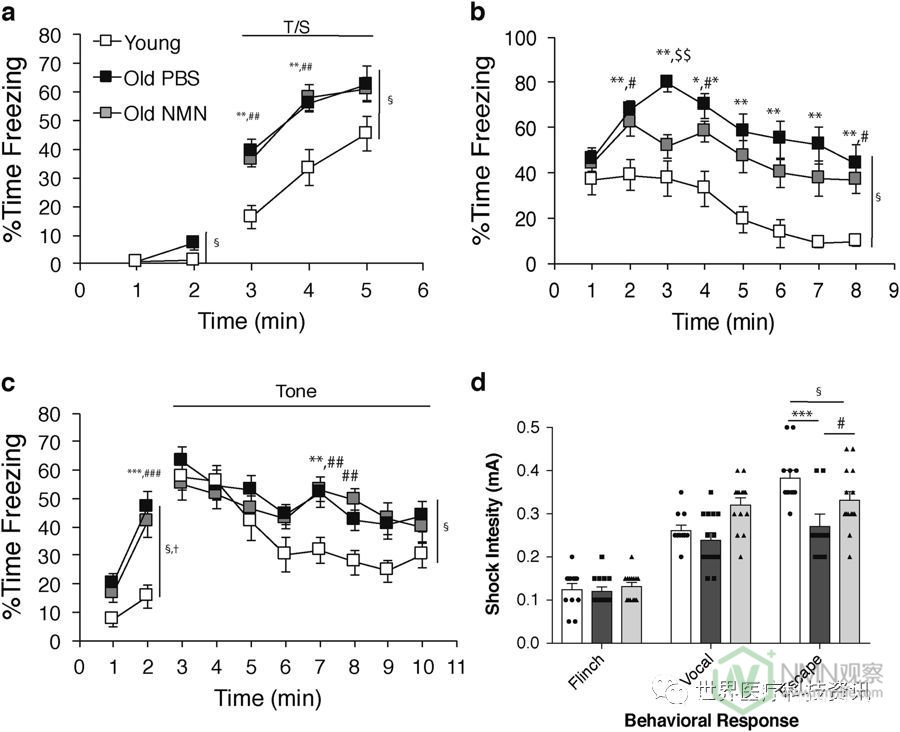
老鼠表现出认知超敏反应,其方面由NMN改善。一个 - ç情景恐惧条件反射测试上进行PBS处理的2个月大的(Ñ = 12),PBS处理的20个月大的(Ñ = 14),和NMN处理的20个月大的(Ñ = 14)雄性小鼠。在第1天(a)的基线和音调 - 休克(CS-US)训练期,第2 天(b)的情境恐惧条件反射和第3天(c)的听觉线索期间显示冷冻时间百分比的值。通过双向重复测量(rm)ANOVA进行统计学分析,并且通过单向ANOVA评估每个时间点的差异。d对于(a-c)中使用的相同组小鼠,显示了对退缩反应,发声和逃避反应的休克敏感性。数据表示为平均值±SE。重要的群体效应和逐个时间的相互作用用图表右侧的符号表示(分别为§和†); #p <0.05,**,## p <0.01,***,###,$$$ p <0.001(**,***对于PBS治疗的年轻人与PBS处理的大的小鼠; #, ##,###用于PBS处理的年轻与NMN处理的老鼠; $$$用于PBS处理的旧对NMN处理的老鼠)
为了帮助解释在条件性恐惧测试期间观察到的性能差异,随后评估小鼠组对足部休克的敏感性。尽管发现退缩和发声没有显着的群体效应,但发现逃避行为的强烈,显着的群体效应(图2d ;单向ANOVA,F ( 2,37 ) = 8.48,p = 0.0009)。成对比较的结果显示,与在PBS处理的幼鼠中观察到的相比,PBS处理的老鼠中显着较低的休克水平引起逃避行为(p = 0.0002)。重要的是,与PBS治疗的老鼠相比,在NMN治疗的老鼠中引起逃避反应需要显着更高的休克水平(p = 0.020)。对于发声也观察到类似的趋势。这些结果表明老年小鼠中存在高度致敏作用,这反映了感觉加工和情绪(恐惧和/或焦虑)的改变。值得注意的是,虽然在第1天的初始基线期间各组之间没有观察到冷冻水平的差异,但是与第3天相比,在第3天的改变背景基线期间,每个老组显示出显着更高的冷冻水平。老鼠。这表明在第2天的情境恐惧测试期间观察到的与年龄相关的差异不是由于调理/保留的差异,而是由于在两个老年人接触足部休克后对一般实验程序的敏感度提高。组。从而,
CA1特异性Nampt敲低概括了条件性恐惧反应中与年龄相关的超敏反应
以前的研究表明,通过FK866(一种有效的NAMPT抑制剂)抑制其酶活性或通过小干扰RNA进行敲低来靶向Nampt可以显着降低NAD +的细胞内含量。17,21由于两者NAMPT表达和NAD +在老化的过程中海马含量减少,我们推测海马NAD还原+通过减少水平NAMPT表达可以概括在年老小鼠中观察到的认知表型。我们还假设NAD +的区域特异性减少水平可能很重要,因为CaMKIIαNampt - / -小鼠的认知表型与野生型老鼠的认知表型非常不同。22
为了解决这些假设,我们决定创建Cornu Ammonis 1(CA1)特异性Nampt敲低小鼠,因为CA1区域最容易受到压力和其他神经退行性变化的影响。23,24,25只两侧装接loxP NAMPT在3月龄小鼠与携带Cre重组酶和绿色荧光蛋白(GFP)基因(酶Cre-GFP)或GFP基因独自走进海马CA1区腺相关病毒立体定向注射。注射的Cre-GFP病毒局限于背侧CA1区域,仅在CA1区域显示出约60%的Nampt表达敲低,而在CA3和齿状回(DG)区域则没有(图3a))。在注射后4周,在同一组行为测试中评估这些CA1特异性Nampt敲低(CA1 Nampt KD)和GFP病毒注射对照(GFP CON)小鼠。两组在一般走动活动方面没有差异,每一组都表现出逐渐下降的水平,反映了对新环境的适应性(图3b)。CA1 Nampt KD和GFP CON小鼠也在感觉运动测量电池上进行类似的操作(数据未显示)。此外,在MWM测试期间,两组在线索,位置或探针(图3c,d)试验中没有观察到显着的性能差异。
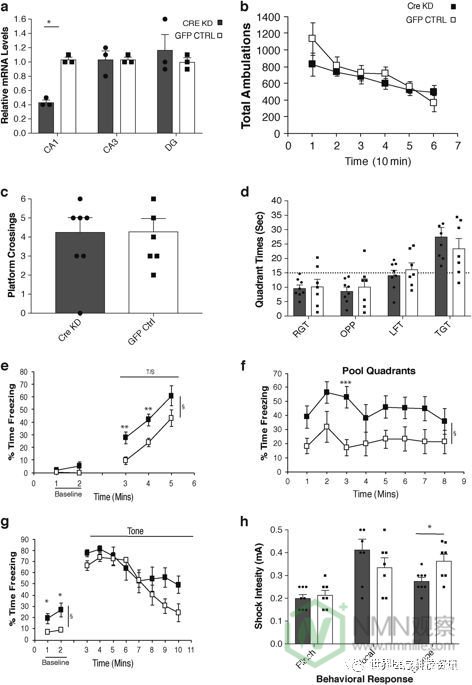
在条件性恐惧程序的第1天,在基线期间观察到CA1 Nampt KD和GFP CON小鼠之间的类似冷冻水平,尽管CA1 Nampt KD小鼠在音调 - 休克训练期间确实表现出显着增加的冷冻水平(图3e ;组效应:F (1,11) = 14.33,p = 0.003),成对比较显示 在第3分钟期间各组之间的显着差异(根据Bonferroni校正:p <0.05 / 3 = 0.017)(p = 0.008)和4(p = 0.005),并且在第 5分钟期间有很大的差异(p = 0.043)。重要的是,CA1 Nampt相对于GFP CON组,KD小鼠在情境恐惧测试期间显示出显着增加的冷冻水平(图3f)(组效应:F (1,11) = 7.34,p = 0.020)。随后的成对比较显示 组间3分钟(p = 0.0002)有显着差异(根据Bonferroni校正:p <0.05 / 8 = 0.0063 ),在1分钟(p = 0.039)和5分钟时观察到较大差异(p = 0.019)。因此,CA1 Nampt KD和GFP CON小鼠之间的冷冻水平差异与上述年轻和老年小鼠之间观察到的相似(图2b))。在分析中将性别作为变量包括在内,因为在该队列中使用了男性和女性,并且对于音调 - 休克训练和情境恐惧测试数据( 分别为p = 0.004和0.005)发现了显着的性别影响。然而,没有观察到性别以任何方式与群体显着相互作用。第3天改变的背景基线数据表明,当放入含有新环境线索的室时,CA1 Nampt KD小鼠相对于GFP CON组也显示出增加的冷冻水平(图3g ;组效应:F (1,11)) = 9.97,p = 0.009),在分钟1(p = 0.024)和2(p = 0.014)。这些结果表明,在情境恐惧测试(第2天)期间观察到的组之间的差异是CA1 Nampt KD小鼠的增强的致敏作用的函数而不是真正的调理/保留作用。第3天的听觉线索测试显示,对于组变量和组间的相互作用没有显着影响,尽管有相互作用效应显着的趋势(p = 0.063),并且CA1之间存在冷冻水平差异的趋势。Nampt KD和GFP CON小鼠在3分钟(p = 0.049),9分钟(p = 0.057)和10分钟(p = 0.061)。从第3天数据的分析中未发现显着的性别影响。对足部休克的行为反应显示CA1 Nampt KD小鼠在逃避行为中表现出增加的敏感性(降低阈值)(图3h ;组效应:F (1,11) = 8.52,p = 0.014),而没有显着组对其他两种休克诱导的行为反应观察到了影响(图3h),也没有任何涉及性别的显着影响。因此,CA1 Nampt 与GFP CON小鼠相比,KD小鼠显示出认知超敏反应,其与来自音调 - 休克训练,情境恐惧测试和年轻和年老小鼠之间发现的改变的背景基线的年龄相关结果非常相似。
为了评估是否可以通过敲除其他海马区域的Nampt来观察这种认知超敏反应,我们还创建了DG特异性Nampt敲低小鼠。所述NAMPT敲低效率为〜40%(图4A)。这些DG特异性Nampt敲低小鼠在情境恐惧条件试验中没有表现出认知超敏反应(图4b-d)。这些结果表明CA1在老年小鼠中发展与年龄相关的认知超敏反应中起重要作用。
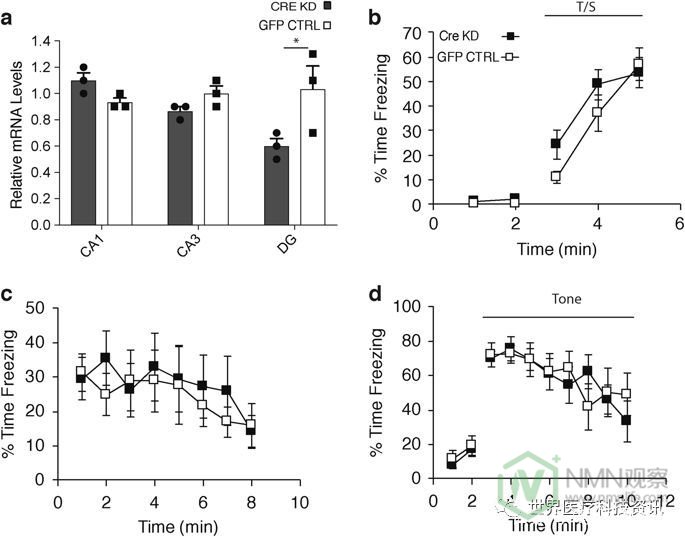
DG特异性Nampt敲低小鼠不显示认知超敏反应。在DG特异性Nampt敲低和注射GFP的对照小鼠的CA1,CA3和DG区域中的 Nampt mRNA水平( 每组n = 3只小鼠; * p <0.05,未配对的Student's t-检验)。b - d对DG特异性Nampt敲低(n = 7)和GFP注射对照(n)进行背景恐惧条件试验 = 6)老鼠。从对恐惧条件反射程序的任何组成部分进行的分析中未发现按时间相互作用的组或组的显着主效应。从第1天(b)的音调 - 休克(CS-US)训练期,第2 天(c)的情境恐惧条件反射和第3天(d)的听觉线索期间显示冷冻时间百分比的值。双向rmANOVA未检测到统计学差异。数据表示为平均值±SE
为了找到对海马NAD +水平降低有反应的潜在候选基因,我们首先用浓度为10 nM和100 nM的FK866处理原代海马神经元48小时。细胞NAD +水平分别在10nM和100nM FK866下降60和80%(图5a)。尽管如此,在使用100nM FK866的48小时处理中细胞存活率仅略微降低(图5b)。因此,我们使用用100nM FK866处理48小时的原代海马神经元进行微阵列分析。26在该响应细胞NAD基因+下降,我们发现命名为钙/钙调蛋白依赖性丝氨酸蛋白激酶的基因(桶)。据报道,Cask与X连锁精神发育迟滞和自闭症谱系障碍有关。27,28木桶是已被报告给调解携带囊泡的顺行传输多畴支架蛋白Ñ甲基D天冬氨酸受体(NMDAR)亚基,特别GluN1和GluN2B,在神经元。29 桶在初级海马神经元表达降低由FK866治疗,但恢复由FK866(图的存在下加入100μMNMN 5C)。在整个海马离体培养物中也证实了FK866 对Cask表达的减少(图5d)。
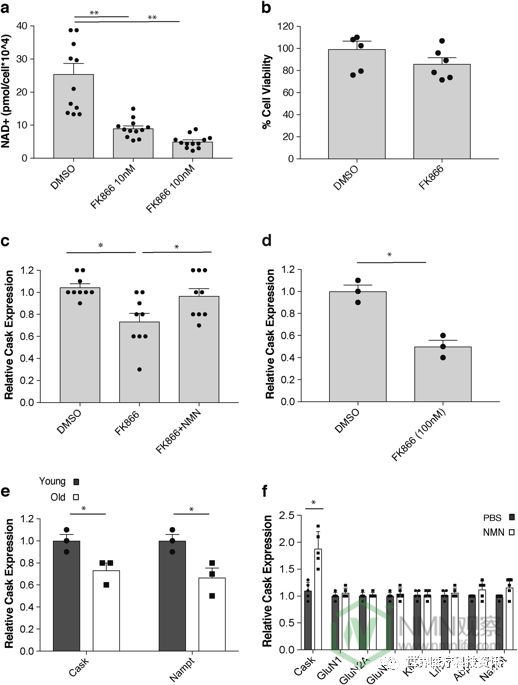
与我们的发现海马NAD +水平随年龄增长而下降一致(图1a),我们发现海马中2至19个月的Cask表达也显着降低~30%(图5e)。我们能够确认Nampt表达在海马中随着年龄的增长而降低(图5e)。值得注意的是,老年小鼠的NMN补充能够使Cask表达特异性增加~2倍,而其他基因(包括NMDAR亚基和囊泡转运亚基)的表达对NMN的反应没有显示出显着变化(图5f)。因此,Cask以NAD +依赖性方式调节表达,并且通过体内 NMN补充可以恢复其与年龄相关的减少。
SIRT1 响应NAD +调节Cask表达
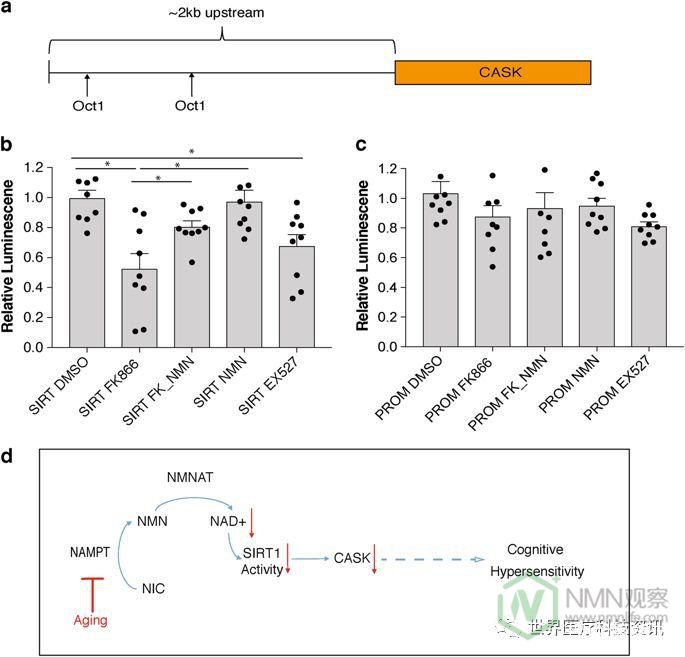
一组主要的NAD +依赖介质是sirtuin家族。11特别是SIRT1在调控海马功能,包括长时程增强以及学习和记忆一个显著的作用。12,13为检测是否NAD +的依赖性调节木桶通过任何沉默调节蛋白家族成员,特别是介导的SIRT1,我们采用了瞬时转染测定法通过构建萤光素酶报道通过的〜2kb的上游基因组片段从动酒桶基因(图6a)。我们使用HEK293细胞进行该测定,因为它们具有非常低的SIRT1蛋白的内源表达。我们发现了Cask当Sirt1小基因共转染时,启动子对NAD +水平的变化有响应+(图6b)。当NAMPT介导的NAD +生物合成被FK866抑制时,Cask启动子活性降低,而通过在FK866存在下添加NMN显着恢复其活性。当没有引入SIRT1时,未观察到Cask启动子的这种NAD +依赖性(图6c)。此外,在SIRT1存在的情况下,有效的SIRT1抑制剂EX527显着抑制了Cask启动子活性(图6b,c)),支持SIRT1 对Cask启动子的NAD +依赖性调节的依赖性。总之,Cask表达似乎以NAD + / SIRT1依赖性方式调节,并且年龄相关的NAD +减少最有可能导致Cask表达的下调,可能导致海马认知功能的年龄相关变化。 。
讨论
在我们目前的研究中,我们发现老年小鼠在暴露于某些厌恶的环境刺激后会产生认知超敏反应,可能反映了与情绪(恐惧和/或焦虑)和感觉处理有关的年龄相关的改变。这种超敏反应表现为在音调 - 休克训练期间大大增加的冰冻水平,以及情境恐惧和听觉线索测试。年龄相关的休克敏感度差异可能在老鼠在第1天的音调 - 休克训练期间显示的这种加剧的冷冻反应中起作用,这可以增加足部休克的显着性并且导致增强的调理,从而导致在情境恐惧和听觉线索测试期间增加了冰冻水平。然而,在第3天测量的改变的背景基线期间增加的冷冻水平表明冷冻与背景和听觉提示的这些差异并不代表真正的调理/保留效应。相反,旧的老鼠对暴露于足部休克后的条件性恐惧程序期间发生的一般环境变化变得过敏。有趣的是,对老年小鼠的NMN补充能够减轻年龄相关的认知超敏反应和年龄相关的休克敏感性增加,从而提高NMN补充程序的修改(例如,延长的治疗持续时间)可能导致更大的积极影响。年龄相关的超敏反应的假定情绪成分。
上述年龄相关的认知超敏反应可能是由于海马NAD +下降,因为老年小鼠的降低的休克敏感性阈值可以通过短期NMN补充来改善。此外,Nampt的 CA1特异性但非DG特异性消融概括了老年小鼠的认知超敏反应,为NAMPT介导的NAD +生物合成在海马认知功能中的作用提供了支持。我们还发现Cask表达受NAD + / SIRT1依赖性调节,并且海马Cask表达在老鼠中特异性下调。在其产物参与神经元囊泡转运和突触功能的基因中,只有Cask在老年海马中显示出显着的上调以响应短期NMN补充。这些结果表明,NAMPT介导的NAD +生物合成的年龄相关性减少有助于老化期间海马依赖性认知功能的改变。
已经确定,在衰老过程中,多种外周组织以及脑中的NAD +水平显着降低。6NAD +的减少至少部分是由于Nampt表达减少。例如,我们之前和当前的研究表明,海马中NAD +和Nampt的水平随着年龄的增长而降低。17有趣的是,消融NAMPT成人神经干/祖细胞(NSPCs)在老化过程中概括它们的功能缺陷,并且在老化期间在NSPC池中的降低可以通过显著NMN补充解救。17因此,衰老期间NAMPT和NAD +的丧失可引起小鼠中多种认知和行为方式的显着变化。事实上,CaMKIIαNampt - / -小鼠在前脑兴奋性神经元中特别缺乏NAMPT,表现出多种行为和认知障碍,包括多动,记忆力减退和焦虑减少。22然而,这些小鼠不能概括老龄小鼠检测的认知过敏。相反,CA1特异性Nampt敲低小鼠能够重现这种老鼠的特定认知表型。是否与年龄相关的NAD +与其他海马区域相比,CA1区域的减少程度更大,仍未得到解决。在衰老过程中测量不同海马区域的NAD +水平将是非常重要的。
为什么老鼠会出现认知过敏症表型?我们已将Cask鉴定为潜在的下游靶标,以响应海马中与年龄相关的NAD +减少。木桶表达对海马神经元和体内的NAD +变化敏感。在老化过程中,海马中的木桶表达显着下调,这可以通过NMN补充来改善。Cask是一种多区域支架蛋白,在细胞连接和突触中很重要。30具体而言,木桶已报道与NMDAR的GluN2B亚基和工作在用于容纳GluN2B的囊泡运输的备选分泌途径相互作用。29木桶缺乏导致突触NMDAR减少约40%。29此外,木桶可以潜在地转位到细胞核中,并用T-脑-1(TBR1),特定的脑-T-box转录因子相互作用。30,31,32,33木桶TBR1相互作用重要的是提高TBR1的转录活性和上调 GRIN2B( GluN2B)的表达。32,34,35,36 GluN2B确实其信使RNA(mRNA)和蛋白质表达示出了老化期间显著减少亚基。37,38,39,40因此,年龄相关降低木桶表达通过影响其表达水平和/或将其运输到突触可能可能危及含GluN2B-NMDA受体的功能。鉴于与在突变个体木桶基因开发智力迟钝和孤独症谱系障碍, 27,28可以想到的是,在年龄相关的还原木桶表达可以通过含有GluN2B-NMDA受体的功能障碍引起广泛的认知损害的。需要进一步调查以检查CA1特异性敲除 Cask或Grin2b 可以概括在老鼠中观察到的认知超敏反应。
有趣的是,Cask表达似乎以SIRT1依赖性方式进行调节。因为EX527消除了Cask启动子的SIRT1依赖性激活,所以SIRT1 的NAD +依赖性脱乙酰酶活性是该转录调节所必需的。然而,SIRT1用于调节Cask启动子的目标仍然未知。我们试图通过染色质免疫沉淀来观察SIRT1是否物理地存在于Cask启动子上。然而,到目前为止,我们未能检测到Cask启动子上SIRT1的存在(数据未显示)。因此,SIRT1可能使一种关键转录因子去乙酰化并激活其转录活性木桶推进器。
总之,我们提出以下模型(图6d)。在正常衰老过程中,海马神经元,特别是CA1神经元,经历NAMPT和NAD +水平的显着下降。这种NAD降低导致SIRT1活性降低,导致老年海马中Cask表达降低。Cask的这种减少可以减少突触中GluN2B的定位,促进老化期间海马认知和行为功能的改变。重要的是,NMN,一个关键的NAD +中间体和NAMPT反应的主要产物,可以改善我们在老鼠中观察到的认知超敏反应的某些方面。如果在老年人中也观察到这种认知超敏反应,NMN给药可改善他们的健康状况并可能提高他们的生活质量。
总之,我们的研究表明认知和行为功能的年龄相关改变是由老年小鼠海马中NAMPT介导的NAD +生物合成减少诱导的,特别是在CA1区。我们的研究还表明,NMN补充剂,即使在短期内,也能够减轻一些厌恶刺激的感觉加工中的年龄相关改变以及可能的其他相关行为。虽然进一步的详细分析是必要的,但我们的研究结果提供了关于衰老如何影响认知和行为功能以及如何预防或治疗这些损伤以提高我们后来生活质量的重要见解。
方法
动物
在12小时光照/黑暗循环下,以常规饲料饮食随意维持小鼠。将所有小鼠品系维持为纯合菌落。Floxed Nampt(Nampt flox / flox)小鼠41用于产生CA1特异性Nampt敲低小鼠。在所有实验中,对照小鼠是年龄匹配的同窝小鼠。老年C57BL / 6小鼠及其年轻对照由国家老龄化研究所提供。所有动物程序均经华盛顿大学机构动物护理和使用委员会批准,并符合美国国立卫生研究院的指导原则。
认知和行为评估
行为测试在圣路易斯华盛顿大学医学院的动物行为核心进行。对三个小鼠组中的每一个的评估包括一组感觉运动测量和1小时运动活动,MWM和情境恐惧调节(包括休克敏感性)测试。与先前描述的方法类似地进行和分析所有测试。22补充资料中提供了这些程序的完整说明。
立体定向注射携带Cre重组酶和GFP基因的腺相关病毒(AAV-Cre-GFP)
AAV血清型8由Hope Center病毒载体核心提供和产生。按照前述方法,给小鼠注射AAV-Cre-GFP或AAV-GFP。42识别前囟,并记录立体定向注射的适当坐标:相对于前囟,对于CA1,前 - 后(AP)-2 mm,内侧 - 外侧(ML)±1.5 mm和背 - 腹(DV) - 1.7毫米; 对于DG,AP为-1.5 mm,ML±1.5 mm,DV为-2 mm。缓慢注射实验或对照AAV(0.2μl/ min),总体积为1μl。切口用4-0尼龙缝线封闭。注射后立即给动物皮下注射缓释的补肾上腺素作为镇痛药,并在温度调节的培养箱(32℃)中恢复直至完全清醒,然后转移到隔离的动物室中72小时。保持不受干扰。在用于任何实验之前,所有注射的小鼠都有4周完全恢复。
NAD +测量
如前所述,使用具有Supelco LC-18-T柱(15×4.6cm,Sigma)的HPLC系统(Shimadzu)测定NAD +水平。43
原代海马神经元的分析
如前所述,分离原代海马神经元。44简要地,海马,从E16.5-E18.5 C57BL / 6J胚胎解剖并在含有休眠-E(Gibco)中解剖溶液置于冰上。通过在0.25%胰蛋白酶-EDTA(Sigma)中于37℃温育20分钟来消化海马。加入DNase I,并将海马在室温下温育5分钟并用电镀介质洗涤两次,然后通过在电镀培养基中移液直至最终研磨直至没有残留团块。细胞接种在涂覆有100μg/ ml的聚井升-lysine(Sigma)并在体外2天后用10μMAra-C(Sigma)处理。在Ara-C存在下选择的原代海马神经元用10或100nM FK866或二甲基亚砜(DMSO)处理并收集并快速冷冻用于NAD +测量和其他分析。使用Pierce LDH细胞毒性测定试剂盒(Thermo Scientific)评估细胞活力。将样品储存在-80℃直至提取。用PureLink RNA Mini试剂盒(Ambion)制备RNA样品用于定量实时逆转录聚合酶链反应(qRT-PCR)。
定量实时RT-PCR
用High-Capacity cDNA Reverse Transcription Kit(Applied Biosystems)将RNA逆转录成互补DNA(cDNA)。使用TaqMan Fast Universal PCR Master混合物和GeneAmp 7500快速序列检测系统(Applied Biosystems)中每种基因的适当TaqMan引物进行qRT-PCR。为了测量CaskmRNA,使用SyBR绿色探针。Cask的引物序列是:正向5'-GAAACCAGTTTAGGCATTTGCT-3'; 反转5'-TGAAATGAAGGACCCAAAGG-3'。通过归一化至GAPDH(甘油醛-3-磷酸脱氢酶)表达水平然后至对照,计算每种基因的相对表达水平。
激光显微切割海马亚区
使用Leica LMD 6000系统(Leica Microsystems,Buffalo Grove,IL,USA)通过激光显微切割进行认知和行为测试后,从注射AAV-Cre-GFP或AAV-GFP的小鼠解剖CA1,CA3和DG。使用Arcturus PicoPure RNA Isolation Kit(Life Technologies,Grand Island,NY,USA)从每个海马亚区域分离RNA。如前所述,45为定量RT-PCR,各RNA浓度通过纳米滴确定,并且cDNA用Applied Biosystems的高容量cDNA逆转录试剂盒(Life Technologies公司,格兰德岛,NY,USA)合成。
荧光素酶测定
如前所述进行荧光素酶测定。用由~2kb启动子驱动的荧光素酶报告基因和仅携带Sirt1启动子的Sirt1小基因或对照载体转染45个 HEK293细胞。46
统计分析
所有数据均表示为平均值±SE。通过未配对的Student's t检验确定对照和实验样品之间的统计学显着性,统计显着性为p <0.05。对于行为数据,使用ANOVA模型。含有一个受试者间变量(基因型)和一个受试者内(重复测量)变量(例如,时间或会话)的rmANOVA模型通常用于分析1小时运动活动,MWM和条件恐惧数据。由于使用了雄性和雌性,因此还将性别作为CA1特异性Nampt敲低研究的主体间变量。Huynh-Feldt纠正了p提供了包含两个以上水平的所有受试者内部效应的值,以帮助防止rmANOVA模型背后的球形度/复合对称假设的违反,尽管列出了未调整p值的自由度。通常,单向ANOVA模型用于分析组之间的差异,用于1小时运动活动中的测量和感应运动电池测试以及MWM探针试验期间目标象限中的平台交叉和时间。在发现相关的,显着的总体ANOVA效应并且在适当时进行Bonferroni校正之后进行简单的主效应测试和成对比较。的p等于0.0000的值被列为p <0.00005。

