《自然》杂志回顾百年抗衰老研究,提出了7种“延长寿命”手段
《自然》杂志创刊于1869年,是世界上最权威的科学杂志之一。古代几位皇帝的对“长生不老”的失败尝试,使得民间对抗衰老多有“异端邪说”的看法,然而科学界似乎已建立了严密的抗衰老研究体系。
为庆祝创刊150周年,《自然》杂志推出了一系列综述文章,其中就包括本文的“续命”研究。本文回顾了抗衰老研究的百年历史,提出了7条相对“靠谱”的靠衰老策略。有意思的,有两条直接与NMN相关(Sirtuins和沉默调节蛋白激活剂)。
几十年来,生物学家一直面临着如何理解衰老和寿命限制的挑战。三十年前,通过鉴定延长多细胞模型生物寿命的基因变异,衰老生物学获得了前所未有的科学可信度。在此,我们总结了标志着这一科学胜利的里程碑,探讨不同的衰老机制和过程,并指出老龄化研究正在进入一个具有独特医学特征、商业和社会影响的新时代。我们认为,这个时代标志着一个拐点,不仅在老龄化研究中,而且对所有影响人类健康的生物研究中也是如此。
老龄化研究的关键的一步是1939年观察到限制小鼠和大鼠的热量摄入可延长寿命(图1)1。随后,在多种物种中也证实了这一发现,最近,在灵长类动物2,3中,首次证实衰老过程的可塑性,过程可塑性的首次证明,也是遗传研究的先兆,这也是50年后遗传学研究的先兆。显然,饮食限制不仅仅增加最大寿命,而且可以抑制与衰老引起的疾病的发展4。这些发现证实了一个概念:寿命的延长与延缓衰老,健康寿命的延长有关(健康寿命的长度和没有疾病的总寿命的比例)。
在20世纪中叶,这一领域开始辩论一个观点:衰老是与年龄相关的慢性病的病因。而“病因”这一用词仍有争议,因为尽管衰老是年龄相关性疾病最重要的风险因素5,但其因果关系仍不能证实。一些明显的正常的衰老现象,以一种复杂的方式相互作用导致疾病,支持这一观点。人们意识到,正在研究的许多决定衰老速度的分子和生化机制的实验室,只关注慢性疾病。有趣的是,研究寿命遗传学和疾病模型的研究人员越来越多地与缺乏老龄研究专门知识的科学家合作。为了将这一新领域与老年学(gerontology)区分开来,老年学被定义为老年和老年人的综合多学科研究,这门介于正常老龄化和慢性病之间的跨学科科学被称为“老年科学”(geroscience)6。
衰老研究的遗传学方法
生物学家早就知道,寿命是一种可遗传的特性,因此具有遗传基础,因为不同物种的寿命从几天到几十年不等,相差很大。1952年,彼得·麦达瓦尔(PeterMedawar)提出,衰老是生殖后自然选择力下降的结果7。这使得一些人——遗传学家和进化生物学家——培养了大苍蝇种群(通常是果蝇物种),具有较高的遗传多样性,有选择地后期和早期繁殖后代,并测试它们的遗传组成。这些研究结果显示:晚期繁殖蝇的寿命机会是早起繁殖蝇的两倍,并且这种差异是可遗传的,这证实了基因决定寿命的想法8。
在麦达瓦尔写了关于衰老的著作后三十年,一项具有里程碑意义的研究表明,在秀丽隐杆线虫中,单一基因age-1,能够决定生物体寿命的长短9。Age-1基因突变虫的平均寿命可增加40-60%9。这让许多人感到惊讶,因为研究人员认为,寿命涉及成百上千个基因,任何一个基因的影响都非常小,甚至无法检测到。目前,根据GenAge,已经发现了800多个能调节线虫寿命的基因。
调节寿命的实际基因数量可能更大,因为新的长寿突变不断被发现,并且在不同的环境条件下,其他基因也可能影响寿命。
衰老的通路和过程
在过去30年,关于衰老研究已经从识别衰老表型转变为研究这些表型的遗传途径。衰老遗传学研究揭示了一个细胞内信号通路和高阶过程的复杂网络10。众多的通路和过程,如饮食限制,在对环境变化的稳态反应中是至关重要的。
以下,我们筛选了过去三十年出现的一些关键的通路和过程。
胰岛素样信号通路
线虫基因中的daf-2控制正常发育进程和滞育幼虫交替阶段之间的转换,在1993年,有文章证实当daf-2发生突变时,其寿命是正常成年虫的两倍11。随后,又发现两个daf家族基因(daf-2和daf-16)均处于一条信号通路,影响着幼体发育和成虫寿命12。这些与寿命相关的基因是哺乳动物与线虫的同源基因,编码细胞内胰岛素和胰岛素样生长因子信号通路(ILS)的相关组成。在哺乳动物中,age-1 是一种磷脂酰肌醇-3激酶,daf-2编码胰岛素样受体,daf-16编码FOXO样转录因子,该转录因子是胰岛素信号通路的下游信号。在酵母和果蝇中14,15也得到了相同的研究结果,即抑制ILS通路的成分以延长寿命。这表明,早期在线虫中的发现并不是一种“限制于线虫的私有机制”,而是一种可能与人类和人类疾病相关的共同机制。▲图1 衰老研究的时间轴▲
从1930年发现卡路里限制对衰老的影响开始,重点突出了衰老领域的主要发现。
对果蝇、蠕虫和小鼠的进一步研究证明了抑制胰岛素信号传导途径和延长寿命的效果16。人类中一些daf-16同源基因的等位基因(FOXO 3)也与全球各地的百岁老人群体相关17,这与动物中的研究一致,与人类的衰老相关。
雷帕霉素的靶向
从雷帕霉素的研究中首次发现了雷帕霉素的蛋白靶点(TOR)。雷帕霉素最初发现其有效的抗真菌特性,随后证实,可以抑制细胞的生长,可以充当免疫调节剂18,19。在酿酒酵母中研究其作用机制,发现雷帕霉素可以识别基因突变,抑制细胞周期18。随后研究发现TOR由TOR1和TOR2组成,哺乳动物TOR基因被称为mTOR。
研究还发现TOR和饮食限制之间的关系。演化假说解释了饮食限制的保护性作用——在营养限制下,代谢会从繁殖和生长转向维持机体以延长生存期10。在不同物种的饮食限制中,TOR可作为一个保守的营养传感器,控制从生长和维持转向生存期延长的信号转导。有研究显示,果蝇TOR信号通路的各个成分活性降低,显示出更长的生存期,这模拟出限制饮食的效果20。对酵母长寿基因突变的进行大规模筛选,筛选出几个TOR通路的突变,也模拟出饮食限制的效果13,21。值得注意的是,线虫中,携带TOR和胰岛素信号通路基因双突变的突变体的寿命增加了近五倍22。两条关键的通路(TOR和ILS)是平行且相互作用的保守的营养感应通路,TOR主要控制自主信号,ILS是非自主生长的重要信号通路。
TOR是一种多功能的蛋白质,它作为一个主要的中枢,整合来自生长因子、营养有效性、能量状态和各种压力源的信号10。这些信号调节多个方面,包括mRNA翻译、自噬、转录和线粒体功能,这些功能已被证明是延长寿命的中间环节
Sirtuins 和NAD+
1995年,一个基因筛选发现表观遗传“沉默”因素是长寿基因24。五年以后,在酵母中,Sir2被发现可以调节复制的寿命25。一项关键性的研究发现,Sir2是去乙酰化酶,使哺乳动物组蛋白去乙酰化,但其过程,依赖于细胞辅酶烟酰胺腺嘌呤二核苷酸(NAD+)26。另一项重要的发现是Sir2是酵母在饮食限制下观察到的延长寿命的关键蛋白27。其他生物体也表达与Sir2相关的蛋白,被称为sirtuins,通常作为蛋白脱酰酶,从目标蛋白赖氨酸残基上清除酰基(包括乙酰基、琥珀基和丙二酰)28。小鼠和人表达七种Sirtuins,其特征是一个保守的催化结构域和可变的N端和C端延伸。SIRT1、SIRT2、SIRT3、SIRT6和SIRT7才是真正的蛋白脱乙酰酶,而SIRT4和SIRT5不表现出脱乙酰酶活性,而是从蛋白赖氨酸残基中去除其他酰基29。值得注意的是,SIRT1、SIRT2、SIRT6和SIRT7似乎是对表观遗传起调控作用,而SIRT3、SIRT4和SIRT5位于线粒体中29。Sirtuins被认为是一种代谢调节剂,它控制着人们对热量限制的反应,预防与衰老引起的疾病,从而增加的健康状况,在某些情况下,甚至延长了人们的寿命30-33。
NAD+是存在于所有活细胞中的一种重要的氧化还原辅酶。它既可以作为催化还原氧化反应的酶的关键辅酶,也可以作为其他酶的辅酶底物,如sirtuins和聚腺苷二磷酸核糖聚合酶(PARPs)。更多的证据表明,NAD+水平和sirtuins活性会随着年龄增长、衰老或高脂肪饮食而降低。相反,NAD+的水平会随着禁食、葡萄糖缺乏、饮食限制和锻炼(与低能量负荷相关的条件)而增加34-40。在延长寿命和健康的条件下(比如饮食限制和锻炼),NAD+水平会增加,而在衰老过程中或在缩短寿命和健康的条件下(比如高脂肪饮食)会下降,这支持了NAD+水平下降可能有助于衰老的假说。在此基础上,对其进行了预测和验证,NAD+的补充发挥着抗衰老的作用41,42。
生物钟
对sirtuins的研究也帮助我们理解生物钟和衰老之间的联系。NAD+水平以昼夜节律的方式波动,并通过SIRT1将外周时钟与表观遗传机制对代谢的转录调控联系起来。生物钟的核心机制BMAL 1和CLOCK直接调节NAD+补充途径,调控NAMPT的表达38。SIRT1的去乙酰化酶活性依赖于NAMPT的存在产生NAD+。NAD+浓度在不同细胞间隔中半独立调节的情况表明,独特的局部NAD+浓度的变化可能会对不同sirtuins的活性产生不同的影响。
同样,其他几种体内平衡反应也受生物钟的调节,而生物钟通过神经元、生理和内分泌功能的节律性活动对维持健康至关重要。衰老的一个共同特征是昼夜节律行为模式(睡眠-觉醒周期)的逐渐丧失和昼夜节律基因表达的减弱43。考虑到昼夜节律网络调节着各种生物过程,昼夜节律的破坏——基因上的或环境上的干扰——与衰老相关的疾病发病有关,包括神经退行性变、肥胖和2型糖尿病,这也就不足为奇了43。
饮食限制也正在成为影响外周时钟的一个重要因素,它通过提高生理节律调控的基因表达幅度,促进果蝇和小鼠的昼夜内稳态44,45。更重要的是,饮食限制对果蝇和小鼠的寿命延长作用需要生物钟44,45。饮食限制后肝脏节律性基因的表达增加,包括SIRT1的靶点,NAD+代谢物和蛋白乙酰化46。限时喂养是指在生物体活动的较短时间内进行喂养,它已成为改善昼夜节律和代谢稳态从而延长健康寿命的潜在范式47。这些发现表明,昼夜节律不仅仅是衰老的生物标志,而且可能是机体衰老的驱动因素。
线粒体与氧化应激
在20世纪50年代,有理论认为,内源性氧气产生的氧自由基,以及在呼吸等基本代谢过程中产生的自由基分子,是导致衰老的一个关键因素48。这些理论特别关注线粒体产生的超氧化物作为衰老病理生理学的关键中介49。事实上,许多研究表明,在多种组织和物种中氧化损伤会随着年龄的增长而积累。尽管毫无疑问的是这种损害是细胞和组织年龄增长的最一致的后果之一,但事实证明,这种损害是衰老的原因还是后果仍难以确定。衰老的自由基理论被证明是极其难以检验的,部分原因是活性氧也是重要的信号分子。许多研究表明,调节呼吸可以延长模型生物的寿命50-53。
在20世纪90年代和21世纪初,模型生物被用来过度表达参与解毒自由基分子(如超氧化物)的关键基因。有多种成功的方法可以延长寿命54,55,这表明新陈代谢引起的氧化损伤在一定程度上限制了寿命。然而,这一发现受到了来自小鼠身上研究的挑战,研究显示,关键线粒体抗氧化蛋白超氧化物歧化酶2过表达的野生型动物的寿命没有增加56。然而,针对过氧化氢清除蛋白过氧化氢酶对线粒体的影响的进一步试验研究表明,这种酶可以延长小鼠的健康和寿命57-59。这两项在小鼠身上的发现之间的矛盾表明,哺乳动物系统中简单的基因过表达是与环境非常相关的。这并不奇怪,因为线粒体内自由基的产生是复杂的,在呼吸链内至少有10个位点产生自由基,而且在不同的生理状态、不同的年龄和不同的细胞类型下,自由基的产生速度仍然缺乏探索和特征61。
虽然自由基在高水平时通常与细胞损伤和炎症有关,但它们当出现在较低水平时,也可能通过适应性反应增强细胞防御62。丝裂激素可能贡献于在蠕虫、苍蝇和老鼠线粒体功能受损后观察到的寿命的反常增长63,64。对延长线虫寿命的全基因筛选显示,电子传递链中几个基因的破坏延长了寿命52,65。线粒体电子传递链中基因的抑制引发线粒体展开蛋白反应(UPRmt),这也是延长线虫突变体中寿命所必需的66。神经元线粒体功能的破坏激活远端组织(如肠道)的UPRmt,这表明存在协调组织间代谢的循环因子66。线粒体的紊乱触发了核转录反应,这种反应调控着大量参与蛋白质折叠、抗氧化防御和新陈代谢的基因。UPRmt受多种因子调控,包括与应激相关的活化转录因子(ATFS-1)、同源框转录因子DVE-1、泛素样蛋白UBL-5、线粒体蛋白酶ClpP和线粒体膜内转运体HAF-167。
试验证明有丝分裂激素在延长寿命方面的重要性的研究对该领域提出了若干挑战,因为目前尚不清楚使用抗氧化剂是否是延长寿命的好策略。有证据表明通过增加氧化应激来延长寿命63。同样不清楚的是,在多种物种中,上述发现如何与线粒体功能通过饮食限制得到增强的结果相一致68-70。需要进一步的研究来确定线粒体功能的不同状态如何在不同的环境下影响衰老。
衰老
约60年前,首次发表了关于人类细胞在培养中的分裂能力的有限性的研究成果71,72。这种现象现在被认为是细胞衰老这一更普遍现象的一个例子。衰老细胞具有三个主要特征:抑制细胞增殖、抗凋亡和复杂的衰老相关分泌表型73。限制细胞增殖的衰老主要是由于端粒短而功能失调的端粒,是在缺乏端粒酶的情况下DNA重复复制的结果74。端粒功能失调会引发持续性的DNA损伤反应,进而诱导细胞周期阻滞和促炎因子的表达,这些因子与衰老相关的分泌表型有关76。同样,至少有一些致癌基因通过引起复制压和随后的DNA损伤来诱导衰老77, 78。然而,其他压力源可以在没有DNA损伤反应的情况下促使细胞衰老,包括表观基因组干扰79和线粒体功能障碍80。
衰老细胞在多种衰老和病变组织中更为丰富81。细胞培养研究表明,衰老细胞可以促进多种衰老表型和疾病的特征,主要是通过衰老相关分泌表型的细胞非自主效应促使的82。两种转基因小鼠的试验证实了衰老细胞在体内许多与年龄相关的表型与病理中的表型具有因果关系83,84。这两种模型动物都被用来证明衰老细胞是大量与年龄相关的病理的驱动因素——至少在老鼠身上是这样,这些病理包括阿尔茨海默病85和帕金森病86、动脉粥样硬化87、心血管功能障碍88(包括某些基因毒性化疗引起的心血管问题89)、肿瘤进展88,89、造血和骨骼肌干细胞功能丧失90、非酒精性脂肪肝疾病91、肺纤维化92、骨关节炎93和骨质疏松症94。
这就引出了一个问题:能否找到一种化合物,可以消除衰老细胞(类似于小鼠转基因的作用),继而有可能应用于人类。这种方法导致了一种新药物的鉴定,称为senolytics,并且正在迅速扩大90,95-99。许多senolytic药物已经在小鼠和人类细胞或组织中进行了测试,结果很有前景。然而,只是最近才开始临床试验,因此这些药物是否对人类安全有效还有待确定。
慢性炎症
免疫系统的衰老(称为免疫衰老)是“发炎”的病因之一,指的是一种现象, 在细胞和组织中,年长的生物体往往有更高水平的炎症标记物,引起一个低级、无菌和慢性炎性状态。与急性、短暂性炎症(一种进化上的保守的机制,旨在保护宿主免受感染和伤害)相反,炎症与许多与衰老引起的疾病有关,如癌症、2型糖尿病、心血管疾病、神经退行性疾病和虚弱101-105。
引起炎症的其他因素包括遗传易感性、肥胖、氧化应激、与细菌产物易位相关的肠道屏障通透性的改变(“肠道渗漏”)、慢性感染和免疫细胞缺陷104,以及与非免疫衰老细胞的衰老相关的促炎因子76。此外,许多环境因素(例如Tox21联合鉴定的化学物质)可能具有细胞毒性和促炎作用101,102。最后,延长寿命的措施,如饮食限制,可以降低炎症生物标志物107,108。基于这些发现,炎症现在被认为是加速衰老的生物标志物和衰老生物学的特征之一。
正如对影响衰老的其他因素所讨论的,延长寿命和健康寿命可能是促炎和抗炎过程之间良好平衡的结果109。有研究表明,虽然百岁老人炎性分子水平的增加(例如,白细胞介素- 6,一种常用的慢性疾病指标),与这些促炎分子产生的不良后果被高水平的抗炎分子所抵消110。
蛋白质稳态
蛋白质稳态是维持蛋白质结构和功能的基本过程,在衰老的过程中的逐渐退化。蛋白质组稳定性与生物体的自然寿命有关,如裸鼹鼠,其特征是高水平的稳态蛋白水解活性111-113。在正常的衰老过程中,几百种蛋白质析出,积累在各种组织中。在线虫中,这些不溶性蛋白质对于决定寿命的蛋白质来说是高度富集的114,115。在蛋白质稳定中,全蛋白质组的异常似乎加速了衰老。
决定寿命的主要途径也是调节蛋白质的因素。例如,胰岛素信号通路控制分子伴侣蛋白的表达,TOR信号通路调控多种形式的自噬,包括有丝分裂自噬,这是细胞中去除受损线粒体的机制。与衰老相关的蛋白稳定障碍可能是阿尔茨海默病、帕金森病和其他蛋白质毒性疾病的相关神经肽的加工和折叠异常的机制116。事实上,这可能就是为什么年龄对于以蛋白质聚集为特征的神经系统疾病来说是如此高风险的因素。
对于老龄化分子机制了解的迅速增加为寻找干预老龄化过程提供了新的机遇。从早期的研究中找到了两个十分重要的发现。首先,可以延长寿命的基因数目超过预期,并且它们在老龄化过程的可塑性也超过预期。其次,限制细胞信号通路如TOR和胰岛素信号通路的并控制老龄化的基因在酵母、蠕虫、果蝇和人类中高度保守。这些信号通路跨越进化距离的保守性和有机体模型中这些信号通路增加寿命和健康寿命的现象促进干预人类寿命的想法。
世界快速的老龄化社会正在增加健康护理负担,并导致年龄相关疾病的发病率和费用支出增加,如心血管疾病、中风、癌症、神经退行性疾病、骨关节炎和黄斑变性。然而,现在的医疗护理仍然主要是按照器官和疾病分类,忽略了年龄和老龄化过程是这些疾病最危险的因素。根据老年科学(geroscience)的概念,靶向保守的老龄化通路可以预防多种疾病,并且是处理世界范围内快速增长的疾病负担的不同的方法(Table 1)。

运用老年科学处理年龄相关疾病
老年科学的概念认为保守的老龄化通路是许多年龄相关问题和疾病的部分病理生理原因(图2)。例如,多种慢性病状况下的共患病被认为是老龄化晚期状态多系统的表现,而不是不相关疾病的巧合发生117。因此,靶向保守的老龄化通路应该阻止或者缓解多种临床问题。这种假设有待于在临床试验中评价,但已经得到一些结果的支持。在实验室,大量的特定疾病的动物模型可以通过操作单个老龄化机制(例如NAD+)118或者衰老细胞95进行处理。个体年龄相关疾病的发病率和共患病的发病率随着年龄呈非线性增加,已患有慢性疾病的人群发生新的慢性病的概率较高119。
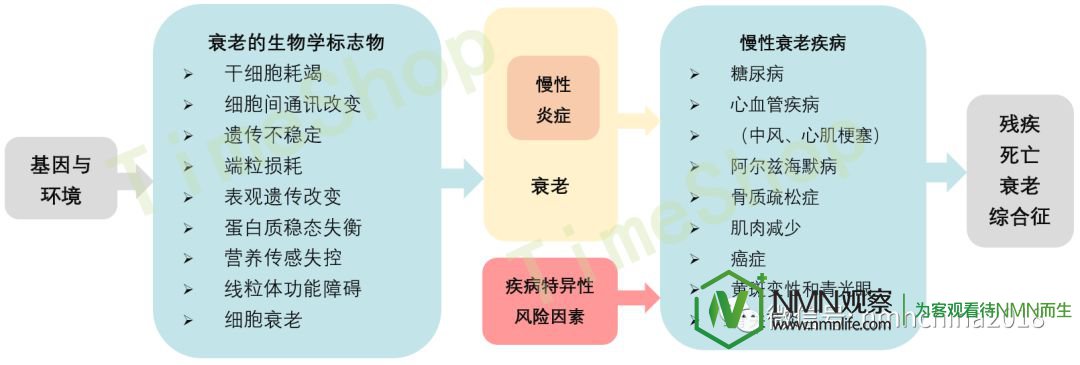
▲图2 老年科学的概念以及它和年龄相关疾病的关系▲
环境和遗传因素对一系列最近被确认为衰老标志的细胞过程和通路的影响193。其中许多通路会引起慢性炎症和衰老的发生,进而增加衰老慢性疾病的风险以及疾病特异性的风险因素(例如,胆固醇水平和高血压可以引起心血管疾病如中风和心肌梗死)。
特定人群,如HIV携带者或者无家可归者,较早地表现出一系列年龄相关的慢性疾病和老年综合征,而这些症状不一定与他们特定的疾病风险相关120,121。人类死亡率的经典统计分析表明即使治愈所有某类慢性疾病,如所有类型的癌症或者心血管疾病,也只能适当延长预期寿命,因为其他慢性疾病会导致预期的死亡122。相反地,假设了解有利老化机制的人们拥有极端寿命,那么大部门主要慢性疾病都会延迟发生123。
在临床应用中,多种慢性病的共患病正逐渐被作为一个需要特定综合治疗计划的整体,因为针对单种疾病的加强但不协调的治疗方案会给复合药物疗法产生不利的症状125。脆弱性测定是临床最广泛应用的评价衰老阶段的评价方法126,127,这些临床生物标记物可以预测肝脏移植患者的死亡率128、手术的并发症129以及阿尔茨海默症患者的病理是否出现临床性痴呆130。综上所述,临床前模型的实验数据、年龄相关疾病的流行病学统计模型以及非疾病特异性的临床衰老评价结果,如各种情况下预测风险和死亡率的脆弱性测定都表明干预衰老的机制可能具有更广泛的临床意义。
未来挑战
然而,从简单有机体转化到人类需要跨越几个关键的难点,如下所述。首先,模型系统研究表明在某种基因环境中发挥作用的干预方法不一定适用于其他情况。例如,多个重组同系繁殖小鼠的饮食限制分析表明动物寿命的延长和减少取决于动物的品系131。150多种苍蝇的研究结果也得到了类似的结果132。假定普遍有效的干预方法所引起的差别的分子基础仍不清晰。采用酵母、蠕虫和苍蝇无脊椎动物开展的研究有助于系统的解释饮食限制延长寿命的遗传基础。
人类还有广泛的遗传差异性,这在很大程度上影响疾病的易感性、寿命和个体对药物的应答程度。这种遗传差异是实现精准医疗的基础,确定疾病的遗传定子,从而可以针对不同的遗传变异体制定个性化干预方法和治疗措施。未来精准医学和老年科学将紧密的相互交叉。如上所述,FOXO3与DAF-胰岛素通路有关,而世界上百岁以上老人发现表达更多的FOXO3 17。APOE参与胆固醇代谢,并且它的唯一的等位基因也与寿命和阿尔茨海默症较低的发病率有关133,134。许多其他的基因135,如SIRT136,也影响人类的寿命。
几项动物研究已表明限制饮食没有普遍的有效性137-139,因此采用药理干预很可能适用于不同的天然存在遗传变异的人群138。类似于小鼠研究结果,不同人群对于营养成分的应答也是有选择性的,这导致遗传差异可能影响糖尿病和肥胖140。另外,动物研究表明大部分研究中的干预方法可以预防衰老。然而,制定了最佳营养和运动计划的人类可能从这些干预中获益不多。根据人们个性化的用药方案调整干预方法可能是从这些干预方法中获取最大有效性的最成功的方案。
上述研究清晰表明小鼠的研究结果不能总用来预测人类结果。许多小鼠研究中的重要发现可以成功转移到人类中,但有一些是不能的。这可能是由于小鼠和人类内在的生物学差异。另外,生物学的复杂性以及可识别的和不可识别的影响生物学表型的变量的多样性可能会引起不同实验室同一有机体研究的重现性问题,这样的研究不限于小鼠,其他模型也有可能141。
虽然许多小鼠研究表明寿命延长和健康寿命延长之间有联系142,143,但苍蝇132和蠕虫144-146研究质疑这项研究结果:寿命的延长总是伴随着健康寿命的增加。在将这些干预方法转移到人类前,需要充分研究这些干预方法的效应问题。
临床试验中的药物
正在研究的靶向衰老的药物和一些正在用的药物在动物模型中都表现为衰老诊疗术。国家衰老研究中心开展的多中心干预检测计划(ITH)已经可以重现性延长遗传上异源小鼠的寿命147,包括雷帕霉素、阿卡波糖、去甲二氢愈创木酸、17-α-雌二醇和阿司匹林147。在一些动物模型的组织中,其中一些药物也改善健康寿命的测定148-150。其他研究中延长啮齿类动物寿命的药物包括二甲双胍(虽然同剂量的ITP试验没有得到重复的结果)151、靶向肽基二肽酶a和盐皮质激素受体的药物、沉默调节蛋白激动剂SRT2104152和SRT1720153。这些药物在有机体模型中的确切衰老诊疗作用需要进一步的验证。
这些干预方法的关键问题是如何在临床研究中在人类身上进行检测和应用。老年科学预测衰老治疗可以缓解或者阻止集中年龄相关疾病和状况的同时发生,评价这种假设的临床试验应该采用多个年龄相关疾病或者状况所得出的临床结果。这些疾病或者状况包括多种慢性病同时发生的共患或者几个年龄相关慢性病的联合;多因素的老年综合征如脆弱或者谵妄;或者对健康刺激因子的反弹如手术或者感染154。共病和脆弱被广泛的整合到评价年龄相关的风险中,并影响临床决策155。类似有用的试验结果检测包括握力、步行速度、起立行走试验和日常起居活动。
衰老的这些临床检测对于选择年龄相关风险高的患者接受干预是有用的。例如,发生共病的风险随着年龄直线增加119;然而发展一种慢性疾病会使发展其他慢性疾病得风险增加几倍157。虽然药物的动物研究和人类的运动研究提供了一些结果表明衰老的窗口期在生命的延后阶段,但在衰老过程的早期或者晚期阶段进行的干预是否有效仍有待观察。目前至少5类药物在人类中进行评价对衰老预防的潜力。
二甲双胍 二甲双胍被广泛的用作抗糖尿病药物,研究发现它也靶向几个衰老机制分子158。接受二甲双胍治疗的糖尿病患者的一项回顾分析表明糖尿病患者寿命较无糖尿病的延长159。在随机研究中,二甲双胍阻止糖尿病的发生,改善心血管风险因素,并降低死亡率160,161。流行病学研究表明二甲双胍的应用也能降低癌症和神经退行性疾病的发生率158。这些数据为二甲双胍靶向治疗衰老(TAME)提供了基础,TAME研究室一项大型随机对照研究,研究内容是65-80岁无糖尿病但发展慢性衰老疾病风险较高的人群服用二甲双胍。TAME研究的主要结果是研究对象死亡或者发展新的主要年龄相关慢性疾病,包括心血管疾病、癌症和痴呆。其他结果包括衰老检测,如活动性、独立生活的能力和认知功能162。
雷帕霉素类似物 ITP评价的化合物雷帕霉素是延长寿命重现性最高的。雷帕霉素抑制TOR通路,延长酵母和苍蝇的寿命,增加多种遗传背景小鼠的平均寿命和最长寿命163-165。采用家养伴侣犬作为临床前模型评价雷帕霉素对心脏功能、认知、癌症和寿命的效应得到的基础数据可以作为临床研究的基础支撑166。雷帕霉素(也称作西罗莫司)和它的类似物依维莫司在临床被用于实质器官移植的免疫抑制剂。健康老年人连续6周接受非免疫抑制剂量的依维莫司后对流感疫苗的应答得到改善19。随后开展的临床试验表明6周的低剂量依维莫司联合另一TOR抑制剂可以改善疫苗应答,并在随后9个月研究对象的感染率降低超过1/3167。这是作用于衰老机制药物靶向衰老的症状之一免疫衰老的两个临床试验。
Senolytics 如上所述,senolytic药物选择性的靶向,并清除衰老细胞,在动物模型中有很好的预防衰老的作用95。这些药物中有些是天然产物,有些是合成的小分子化合物90,98,99。越来越多的生物技术公司和研究型实验室正在研发新的senolytics药物或者调整它们的作用靶点,但仅处于在人类中研究化合物的安全性,对于化合物的有效性仍没有结果。
沉默调节蛋白激活剂 沉默调节蛋白激活化合物(STACs)提高沉默调节蛋白的活性,延长小鼠和非人灵长类动物的健康寿命168。但临床试验观察到混合的结果。白藜芦醇(天然STAC)和SRT1720(早期合成类STAC)在临床前研究中得到了令人兴奋的结果,但临床研究中化合物的生物利用度和潜力均较低,并且化合物的靶向特异性有限169。目前为止,最好的化合物是SRT2104,高选择性的SIRT1激活剂;已经完成了几个小的临床研究,考察了化合物对心血管和代谢标志物的影响,研究对象包括2型糖尿病患者、吸烟者和老年人,大型的临床试验正在进行118。
NAD+前体 NAD+前体例如烟酰胺核糖核苷和烟酰胺单核苷酸用于补充年龄因素引起的细胞内NAD水平的降低69。在动物模型中,两类前体对衰老相关的疾病都表现出预防作用。几个公司目前在线销售烟酰胺核糖核苷和烟酰胺单核苷酸。虽然这些添加剂增加人类NAD水平170,但有效性或者预防人类衰老作用仍没有得到验证。
虽然人们把期望和研究主要放在了药物研究方面,但运动确实是有效的可以预防衰老。由于年龄相关紊乱的治疗没有合适的治疗方案,因此运动成为唯一有效的干预方法,它可以降低年龄相关疾病的发病率171,172,改善生活质量173,同时增加人类的平均寿命和最长寿命174,175。运动的效益在普通的仪器上也可以体现出来173。虽然运动对年龄相关疾病预防作用的关键分子机制仍不清楚,但相关分子机制的研究正在进行,并探讨是否可以利用这种机制去改善老年人的健康状况。
显著营养学领域也出现了一些结果,如间断禁食177、模仿禁食的饮食178和限制时间的饮食179。最近,对生酮饮食的研究逐渐增加,生酮饮食的特点是可以产生高水平内源性的酮体β-羟基丁酸盐。生酮饮食主要用来治疗儿童期癫痫,并在两个独立的小鼠研究中增加健康寿命180-182。近期研究表明β-羟基丁酸盐可以调节表观遗传调节剂的组蛋白脱乙酰基酶类的酶活性,因此激活FOXO3的表达183。饮食干预对寿命和健康寿命的影响将会开展进一步的研究,同时它们与调节衰老信号通路的相互作用仍需明确。
衰老也不是一种疾病,它是多种疾病的重要风险因素,包括心肌梗死、中风、一些衰老相关的癌症、黄斑变性、骨关节炎、神经退行性病变和许多其他疾病。例如,年龄超过40岁时,即使修正其它风险因素后(每10年平均增加一种新的主要风险因素,如吸烟、高血压等),心血管风险每10年增加一倍184。多年的心血管研究确定了风险因素,表明即使患者无症状时也处理风险因素会阻止损害发生。这些心血管生物标志物为指导的治疗可以生命中发现的越来越早。衰老真正生物标志物的可行性、相关的临床健康结果和干预的顺从性162将允许老年预防在加速的时间范围进行。
确认标志物的早期努力没有获得期望结果,但采用新的技术如高通量蛋白组学、转录组学和基因组学获得了新的进展,结果表明这种标志物确实存在,并具有较高的临床重要性185。一个可能的生物标志物是表观遗传时钟,它是基于在多个位点检测DNA甲基化,并与生理年龄相关,同时年龄相关的风险高于实际年龄186-188。高级聚糖化终产物是另一个可能的生物标志物,它随着年龄积聚,并在几种年龄相关的疾病中也积聚189。另外,一些高级聚糖化终产物水平的增加也与人类死亡率的增加有关190。有研究结果表明衰老生物标志物可以通过靶向衰老的干预方法调整,如关于人能量限制的CALERIE研究191。确认可以预测生物年龄和疾病风险的生物标志物将表示我们迈出一大步,以应对人类年龄相关疾病和紊乱。
我们正在进入一个研究衰老的令人兴奋的时代。在这个时代,人们有希望增加人的健康寿命:根据新的科学发现可以阻止、延迟,甚至在某些情况下逆转衰老相关的许多病理变化。在这些研究中能否增加最佳人类寿命仍是个问题192。30年的基础研究发现了与衰老有联系的基因,现在清晰的是衰老研究的基础已经坚实,靶向衰老过程的临床研究已经开始。虽然将研究转移到人类仍会遇到很大困难,但健康衰老的潜在效益远超风险。

